Introducción
El Helicobacter pylori (H. pylori) es una bacteria en forma de espiral que coloniza el estómago humano y se asocia con diversas patologías digestivas.
Su descubrimiento en la década de 1980 revolucionó la comprensión de enfermedades como la gastritis y la úlcera péptica, demostrando que no todas las enfermedades estomacales eran producto del estrés o la dieta.
En este artículo, exploraremos sus características, mecanismos de infección, síntomas, diagnóstico, tratamientos y la discusión sobre si siempre es necesario erradicarla.
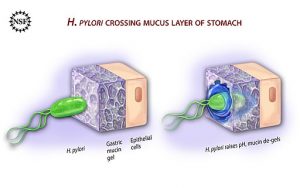
El descubrimiento de Helicobacter pylori y la evolución de su diagnóstico y tratamiento
Introducción
El descubrimiento de Helicobacter pylori (H. pylori) marcó un hito en la medicina moderna, cambiando para siempre la forma en que entendemos las enfermedades gástricas.
Hasta finales del siglo XX, la úlcera gástrica y la gastritis crónica eran atribuidas al estrés, la dieta y la secreción excesiva de ácido gástrico.
Sin embargo, la investigación de dos científicos australianos, Barry Marshall y Robin Warren, desafió estas creencias y transformó el tratamiento de las enfermedades digestivas.
Este artículo explora las diferentes fases del descubrimiento de H. pylori, su diagnóstico y los avances en su tratamiento.
El descubrimiento de Helicobacter pylori
Los primeros indicios: antes de 1980
Desde finales del siglo XIX, algunos investigadores habían reportado la presencia de bacterias en la mucosa gástrica.
En 1875, un equipo alemán describió estructuras espirales en el estómago de perros, pero sin atribuirles relevancia clínica.
Décadas más tarde, en 1940, el patólogo italiano Giulio Bizzozero mencionó microorganismos en el estómago de animales, sugiriendo una posible implicación en la fisiología gástrica.
Sin embargo, la creencia predominante era que el ambiente ácido del estómago era demasiado hostil para que sobrevivieran microorganismos.
Esta idea se mantuvo hasta los años 70, cuando el médico australiano Robin Warren observó que algunas biopsias gástricas mostraban una inflamación persistente acompañada de bacterias en forma de espiral.
El hallazgo de Marshall y Warren (1982-1984)
En 1982, Robin Warren y Barry Marshall realizaron una serie de estudios en pacientes con gastritis y úlceras gástricas. Mediante cultivos bacterianos, lograron aislar una bacteria que denominó inicialmente Campylobacter pyloridis, por su similitud con bacterias del género Campylobacter.
Para demostrar su hipótesis, Marshall llevó a cabo un experimento inusual: en 1984, ingirió un cultivo de H. pylori y, días después, desarrolló síntomas de gastritis. La posterior biopsia gástrica confirmó la presencia de la bacteria y la inflamación de la mucosa, consolidando la relación entre H. pylori y las enfermedades gástricas.
Este descubrimiento llevó a Marshall y Warren a recibir el Premio Nobel de Medicina en 2005, reconociendo su contribución a la medicina moderna.
Evolución del diagnóstico de H. pylori
A lo largo de los años, han surgido diversas pruebas diagnósticas para detectar H. pylori.
Estas se pueden dividir en métodos invasivos y métodos no invasivos:
1. Métodos invasivos (requieren endoscopia y biopsia gástrica)
- Histología: Observación microscópica de la bacteria en una muestra de tejido.
- Cultivo bacteriano: Permite analizar la resistencia antibiótica.
- Test rápido de ureasa: Detecta la actividad enzimática de la bacteria.
- PCR (Reacción en Cadena de la Polimerasa): Método molecular altamente sensible.
2. Métodos no invasivos
- Prueba del aliento con urea marcada: Detecta la actividad de la ureasa bacteriana en el aliento del paciente.
- Test de antígeno en heces: Identifica la presencia de H. pylori en las deposiciones.
- Prueba serológica: Detecta anticuerpos contra H. pylori (menos fiable para detectar infecciones activas).
El diagnóstico ha evolucionado con el tiempo, privilegiando pruebas no invasivas cuando es posible.
Evolución del tratamiento
Década de 1980: Primeros tratamientos experimentales
Los primeros intentos de erradicación incluyeron el uso de antibióticos como amoxicilina y metronidazol.
Sin embargo, la monoterapia resultó ineficaz debido a la rápida resistencia bacteriana.
Década de 1990: Aparición de la triple terapia
El enfoque estándar incluyó:
- Un inhibidor de la bomba de protones (IBP) (omeprazol, lansoprazol) para reducir la acidez gástrica.
- Amoxicilina para atacar la pared bacteriana.
- Claritromicina o metronidazol, dependiendo de la resistencia antibiótica.
Esta terapia tuvo una tasa de éxito del 80-90%, estableciendo un nuevo paradigma en el tratamiento.
Años 2000 en adelante: Terapias cuádruples y personalizadas
Debido a la creciente resistencia a claritromicina, se introdujeron nuevos enfoques:
- Terapia cuádruple con bismuto: Se añadió subcitrato de bismuto para potenciar la erradicación.
- Pylera: Un régimen con cápsulas combinadas de bismuto, metronidazol y tetraciclina, acompañadas de un IBP.
- Terapias secuenciales y concomitantes: Estrategias de tratamiento más flexibles según la resistencia bacteriana.
Hoy en día, el tratamiento se personaliza según la región geográfica y la resistencia antibiótica del paciente.
Conclusión
El descubrimiento de H. pylori cambió radicalmente la medicina digestiva, desmontando mitos sobre la causa de las úlceras y proporcionando un tratamiento eficaz.
Desde su aislamiento en 1982 hasta los avances en diagnóstico y terapias combinadas, el conocimiento sobre esta bacteria sigue evolucionando.
A pesar de los logros, persisten desafíos como la resistencia antibiótica y la decisión de tratar infecciones asintomáticas. La investigación continúa, con la esperanza de desarrollar vacunas y tratamientos más eficaces en el futuro.
Características de H. pylori
Esta bacteria es gramnegativa, microaerófila y altamente adaptada al ambiente ácido del estómago.
Su principal arma es la producción de ureasa, una enzima que descompone la urea en amoníaco y neutraliza el ácido gástrico, permitiendo su supervivencia.
Además, su forma helicoidal y flagelos le facilitan la movilidad a través de la mucosa estomacal, donde se adhiere y prolifera.
Mecanismo de infección y transmisión
Se estima que alrededor del 50% de la población mundial está infectada por H. pylori, con mayor prevalencia en países en desarrollo.
La transmisión ocurre principalmente vía oral-oral o fecal-oral, a través de agua y alimentos contaminados, contacto directo entre individuos o malas condiciones de higiene.
Una vez en el estómago, la bacteria se ancla a la mucosa gástrica y estimula una respuesta inflamatoria crónica. Esto puede llevar a gastritis, úlceras e incluso, en algunos casos, cáncer gástrico.
Epidemiología de Helicobacter pylori
Introducción
Helicobacter pylori (H. pylori) es una de las infecciones bacterianas más prevalentes en el mundo y afecta a una gran proporción de la población global.
Su distribución y prevalencia varían según factores geográficos, socioeconómicos y demográficos.
En este artículo, se analiza la epidemiología de H. pylori, incluyendo su prevalencia, vías de transmisión, factores de riesgo y su impacto en la salud pública.
Prevalencia global
La infección por H. pylori afecta aproximadamente al 50% de la población mundial. Su prevalencia es heterogénea y depende de la región geográfica:
- Países en desarrollo: La prevalencia puede alcanzar el 80-90%, debido a factores como el hacinamiento, deficiencias en el acceso a agua potable y saneamiento deficiente.
- Países desarrollados: La prevalencia oscila entre el 20-40%, con una tendencia a la disminución en las últimas décadas debido a mejoras en las condiciones de vida y en la higiene.
La infección se adquiere con mayor frecuencia en la infancia, y la persistencia de la bacteria a lo largo de la vida depende de factores como la respuesta inmune del huésped y la administración de tratamientos adecuados.
Factores de riesgo
Existen diversos factores que influyen en la infección por H. pylori:
-
Condiciones socioeconómicas:
-
- Hacinamiento en viviendas.
- Falta de acceso a agua potable y saneamiento adecuado.
- Niveles bajos de educación.
-
Edad y transmisión:
-
- La infección se adquiere comúnmente en la infancia.
- La transmisión se da principalmente por vía oral-oral (saliva) o fecal-oral (agua y alimentos contaminados).
-
Factores geográficos y climáticos:
-
- Mayor prevalencia en regiones con climas cálidos y con alta densidad poblacional.
- Disparidades entre áreas urbanas y rurales.
-
Condiciones de salud y factores genéticos:
-
- Historial familiar de infección por H. pylori.
- Enfermedades asociadas, como gastritis crónica y ulceras gástricas.
Impacto en la salud pública
La infección por H. pylori está asociada con diversas patologías, que afectan tanto a individuos asintomáticos como a pacientes con manifestaciones clínicas graves:
- Gastritis crónica: Presente en la mayoría de los infectados.
- Úlceras gástricas y duodenales: H. pylori es responsable de aproximadamente el 70% de las úlceras pépticas.
- Cáncer gástrico: La infección prolongada es un factor de riesgo significativo para el desarrollo de adenocarcinoma gástrico.
- Linfoma MALT: Relacionado con infecciones crónicas por H. pylori.
El impacto global de la infección genera una carga significativa en los sistemas de salud, con costos asociados a diagnósticos, tratamientos y seguimiento de los pacientes.
Tendencias actuales y estrategias de prevención
-
Reducción de la prevalencia en países desarrollados:
-
- Mayor acceso a agua potable y mejora en las condiciones sanitarias.
- Disminución en la transmisión infantil.
-
Nuevas estrategias de tratamiento:
-
- Personalización de los tratamientos según la resistencia antibótica.
- Uso de terapias combinadas y nuevas formulaciones.
-
Investigación en vacunas:
-
- Actualmente en desarrollo, con el objetivo de prevenir la infección en poblaciones de alto riesgo.
Conclusión
Helicobacter pylori sigue siendo un problema de salud pública global con una prevalencia elevada, especialmente en países en desarrollo. La infección está influenciada por diversos factores socioeconómicos y sanitarios, lo que enfatiza la necesidad de estrategias de prevención, detección temprana y tratamiento personalizado.
Aunque se ha logrado una reducción de la prevalencia en algunas regiones, sigue existiendo una preocupación importante por su asociación con enfermedades graves como el cáncer gástrico.
La investigación en nuevas estrategias terapéuticas y vacunas podría representar un cambio significativo en la lucha contra esta infección en el futuro.
Síntomas de la infección por H. pylori
La infección por H. pylori puede ser asintomática en muchas personas, pero en otras puede causar síntomas significativos, incluyendo:
-
Dolor o ardor en la parte superior del abdomen (dispepsia).
-
Náuseas y vómitos.
-
Hinchazón abdominal.
-
Pérdida del apetito.
-
Eructos frecuentes.
-
Pérdida de peso sin causa aparente.
-
En casos más graves, presencia de sangre en el vómito o en las heces (indicando una úlcera sangrante).
Riesgo de cáncer gástrico asociado a H. pylori
El H. pylori ha sido reconocido por la Organización Mundial de la Salud como un carcinógeno del tipo I, es decir, un agente con una relación causal demostrada con el cáncer gástrico.
Se estima que entre el 1-2% de las personas infectadas desarrollará cáncer gástrico a lo largo de su vida. Los factores que aumentan este riesgo incluyen:
-
Infección crónica y prolongada sin tratamiento.
-
Gastritis atrófica y metaplasia intestinal.
-
Presencia de la proteína CagA, una toxina bacteriana que induce inflamación y alteraciones celulares.
-
Factores genéticos y ambientales, como antecedentes familiares de cáncer gástrico y consumo excesivo de alimentos procesados o ahumados.
Se ha demostrado que la erradicación de H. pylori en pacientes de alto riesgo puede reducir la incidencia de cáncer gástrico, especialmente si se realiza antes de que se desarrollen lesiones precancerosas.
Se recomienda investigar la presencia de Helicobacter pylori en un paciente en los siguientes casos:
-
Síntomas digestivos persistentes:
-
- Dispepsia crónica (dolor o ardor en la parte superior del abdomen sin otra causa identificable).
- Náuseas recurrentes o vómitos inexplicables.
- Sensación de plenitud después de comer pequeñas cantidades de comida.
-
Úlceras gástricas o duodenales:
-
- Se debe realizar un test en pacientes con úlceras activas o antecedentes de úlceras pépticas no asociadas al uso de antiinflamatorios no esteroides (AINEs).
-
Antecedentes de cáncer gástrico o lesiones premalignas:
-
- Personas con antecedentes familiares de cáncer gástrico.
- Presencia de metaplasia intestinal o gastritis atrófica en estudios endoscópicos.
-
Anemia ferropénica inexplicada:
-
- Cuando no se encuentra otra causa para la anemia y se sospecha malabsorción secundaria a gastritis atrófica.
-
Púrpura trombocitopénica idiopática (PTI):
-
- Algunos estudios han sugerido una asociación entre H. pylori y esta enfermedad autoinmune.
-
Deficiencia de vitamina B12:
-
- La gastritis atrófica causada por H. pylori puede afectar la absorción de vitamina B12.
-
Pacientes en tratamiento prolongado con inhibidores de la bomba de protones (IBP):
-
- Para evitar el sobrecrecimiento bacteriano y reducir el riesgo de gastritis atrófica.
-
Pacientes con indicación de terapia prolongada con AINEs o aspirina:
-
- Para prevenir el desarrollo de úlceras en personas de alto riesgo.
El diagnóstico puede realizarse mediante pruebas no invasivas como la prueba del aliento con urea, el test de antígeno en heces o serología (aunque esta última es menos útil para detectar infecciones activas). En algunos casos, puede requerirse endoscopia con biopsia gástrica.
Pruebas diagnósticas para detectar Helicobacter pylori
Existen diversas pruebas para diagnosticar la infección por Helicobacter pylori, cada una con diferente preparación y fiabilidad. Se dividen en métodos no invasivos y métodos invasivos.
1. Métodos no invasivos
1.1. Prueba del aliento con urea marcada
Descripción: Se basa en la actividad ureasa de H. pylori, que convierte la urea en CO₂ detectable en el aliento del paciente.
Preparación:
- Ayuno de al menos 6 horas antes del examen.
- Suspender inhibidores de la bomba de protones (IBP) y antibióticos al menos 2 semanas antes.
- No fumar ni masticar chicle antes del test.
Fiabilidad:
- Sensibilidad: 90-95%
- Especificidad: 95-98%
- Considerada una de las pruebas más precisas para detectar infección activa.
1.2. Prueba de antígeno en heces
Descripción: Detecta antígenos de H. pylori en muestras fecales del paciente.
Preparación:
- Evitar IBP, antibióticos y antiácidos 2 semanas antes.
- Se recoge una muestra de heces reciente.
Fiabilidad:
- Sensibilidad: 92-96%
- Especificidad: 93-97%
- Apta para diagnóstico inicial y control post-tratamiento.
1.3. Prueba serológica (anticuerpos en sangre)
Descripción: Detecta anticuerpos contra H. pylori en sangre.
Preparación:
- No requiere preparación especial.
Fiabilidad:
- Sensibilidad: 85-92%
- Especificidad: 75-85%
- Desventaja: No distingue entre infección activa y pasada.
2. Métodos invasivos (requieren endoscopia con biopsia gástrica)
2.1. Test rápido de ureasa
Descripción: Se obtiene una biopsia gástrica y se coloca en un medio con urea. Si H. pylori está presente, la ureasa bacteriana genera un cambio de color en minutos o horas.
Preparación:
- Ayuno de 6-8 horas antes de la endoscopia.
- Suspender IBP y antibióticos al menos 2 semanas antes.
Fiabilidad:
- Sensibilidad: 85-95%
- Especificidad: 98-100%
- Ventaja: Diagnóstico rápido durante la endoscopia.
2.2. Histología (biopsia y análisis microscópico)
Descripción: Se toma una muestra de tejido gástrico y se analiza con tinción especial para detectar la bacteria.
Preparación:
- Igual que el test rápido de ureasa.
Fiabilidad:
- Sensibilidad: 93-99%
- Especificidad: 98-100%
- Ventaja: Permite evaluar daño tisular y detectar metaplasia intestinal o cáncer.
2.3. Cultivo de H. pylori
Descripción: Se obtiene una biopsia y se cultiva la bacteria en laboratorio.
Preparación:
- Igual que el test rápido de ureasa.
Fiabilidad:
- Sensibilidad: 80-90%
- Especificidad: 100%
- Ventaja: Permite estudiar resistencia antibiótica.
2.4. PCR para detección de H. pylori
Descripción: Identifica el ADN de H. pylori en biopsias o heces.
Fiabilidad:
- Sensibilidad: 95-99%
- Especificidad: 98-100%
- Ventaja: Detecta mutaciones de resistencia a antibióticos.
Conclusión
- Para diagnóstico inicial: Se recomienda la prueba del aliento o el test de antígeno en heces.
- Para confirmación y casos complicados: La endoscopia con biopsia es la mejor opción.
- Para detección de resistencias: Se recomienda el cultivo o la PCR.
Opciones de tratamiento para H. pylori
Triple terapia estándar
-
IBP (omeprazol, lansoprazol, esomeprazol).
-
Amoxicilina (1 g cada 12 horas).
-
Claritromicina (500 mg cada 12 horas).
-
Duración: 10-14 días.
Cuádruple terapia con bismuto
- IBP.
-
Subcitrato de bismuto (120-140 mg cuatro veces al día).
-
Metronidazol (500 mg tres o cuatro veces al día).
-
Tetraciclina (500 mg cuatro veces al día).
-
Duración: 10-14 días.
Terapia secuencial
-
IBP + amoxicilina (5 días).
-
IBP + claritromicina + metronidazol (5 días).
-
Duración total: 10 días.
Terapia concomitante
-
IBP + amoxicilina + claritromicina + metronidazol simultáneamente.
-
Duración: 10-14 días.
Terapia de rescate con levofloxacino
-
IBP + amoxicilina + levofloxacino (500 mg cada 12 horas).
-
Duración: 10-14 días.
Tratamiento con Pylera
El Pylera es un tratamiento específico para la erradicación de H. pylori que combina tres principios activos en una sola cápsula:
-
Subcitrato de bismuto (140 mg)
-
Metronidazol (125 mg)
-
Tetraciclina (125 mg)
Pauta de tratamiento con Pylera
-
Se administra tres cápsulas, cuatro veces al día durante 10 días.
-
Se debe acompañar con un inhibidor de la bomba de protones (IBP), como omeprazol 20 mg dos veces al día.
-
Es importante tomar las cápsulas con un vaso lleno de agua para evitar irritación esofágica.
-
Durante el tratamiento, se recomienda evitar el consumo de alcohol (por el metronidazol) y productos lácteos (que pueden interferir con la absorción de la tetraciclina).
Este esquema se ha demostrado altamente efectivo, especialmente en casos de resistencia a claritromicina o fracasos terapéuticos previos.
| Factor | Descripción |
| Presencia de síntomas |
Si el paciente presenta dispepsia, náuseas, vómitos, pérdida de peso inexplicada u otros síntomas digestivos.
|
| Historia de úlceras gástricas o duodenales |
Si el paciente ha sido diagnosticado con úlceras activas o tiene antecedentes de úlceras.
|
| Antecedentes familiares de cáncer gástrico |
Si existen casos de cáncer gástrico en familiares directos, el riesgo aumenta y la erradicación es recomendable.
|
| Gastritis atrófica o metaplasia intestinal |
Condiciones precancerosas que aumentan el riesgo de adenocarcinoma gástrico.
|
| Edad avanzada |
El envejecimiento puede estar asociado con una mayor susceptibilidad a complicaciones gástricas.
|
| Uso prolongado de inhibidores de la bomba de protones (IBP) |
El uso prolongado de IBP puede enmascarar síntomas y alterar la microbiota gástrica.
|
| Púrpura trombocitopénica idiopática (PTI) |
Desorden autoinmune donde la erradicación de *H. pylori* ha mostrado mejorar la condición.
|
| Anemia ferropénica inexplicada |
La infección por *H. pylori* puede interferir con la absorción de hierro, contribuyendo a la anemia.
|
| Deficiencia de vitamina B12 |
La atrofia gástrica inducida por *H. pylori* puede afectar la absorción de vitamina B12.
|
| Factores genéticos |
Algunas variantes genéticas pueden predisponer a una inflamación gástrica más severa.
|
| Consumo prolongado de antiinflamatorios no esteroides (AINEs) |
El uso prolongado de AINEs puede aumentar el riesgo de úlceras, por lo que erradicar *H. pylori* puede prevenir complicaciones.
|
| Condiciones de salud preexistentes |
Pacientes con otras enfermedades digestivas deben ser evaluados antes de iniciar tratamiento antibiótico.
|
| Resistencia antibiótica en la región |
En regiones con alta resistencia antibiótica, la selección de tratamiento debe adaptarse a los patrones locales.
|
| Preferencias del paciente y riesgo-beneficio del tratamiento |
Debe considerarse la tolerancia del paciente a los antibióticos y los efectos secundarios del tratamiento.
|
Reflexión final: ¿Tratamos o convivimos con H. pylori?
La decisión de erradicar H. pylori debe tomarse con criterio médico y basado en la evidencia disponible.
En pacientes con úlceras, gastritis severa o antecedentes de cáncer gástrico, el tratamiento es indiscutible.
No obstante, en personas asintomáticas, la decisión no es tan sencilla.
El uso de múltiples antibióticos y la necesidad de completar tratamientos prolongados con fármacos como Pylera plantean dudas sobre si el beneficio supera el riesgo en aquellos pacientes sin síntomas. Por ello, la estrategia actual en muchos países es individualizar la decisión, considerando factores de riesgo personales como antecedentes familiares de cáncer gástrico, edad, lesiones gástricas precancerosas y resistencia antibiótica en la comunidad.
En conclusión, la erradicación de H. pylori sigue siendo un tema de debate en la comunidad médica.
En individuos con riesgo elevado de desarrollar enfermedades graves, el tratamiento está justificado.
Sin embargo, en pacientes asintomáticos y sin factores de riesgo, la decisión debe tomarse con cautela, sopesando los posibles beneficios y efectos adversos.
Referencias
-
Malfertheiner, P., Megraud, F., O’Morain, C. A., et al. (2017). Management of Helicobacter pylori infection—the Maastricht V/Florence Consensus Report. Gut, 66(1), 6-30.
-
Graham, D. Y., Dore, M. P. (2016). Update on the use of Helicobacter pylori therapy. Gastroenterology & Hepatology, 12(11), 657-665.
-
Sugano, K., Tack, J., Kuipers, E. J., et al. (2015). Kyoto global consensus report on Helicobacter pylori-associated gastritis. Gut, 64(9), 1353-1367.
-
Ford, A. C., Yuan, Y., Moayyedi, P. (2020). Helicobacter pylori eradication therapy to prevent gastric cancer: systematic review and meta-analysis. Gut, 69(12), 2113-2121.
-
Chey, W. D., Leontiadis, G. I., Howden, C. W., et al. (2017). ACG clinical guideline: Treatment of Helicobacter pylori infection. American Journal of Gastroenterology, 112(2), 212-239.
-
Crowe, S. E. (2019). Helicobacter pylori infection. New England Journal of Medicine, 380(12), 1158-1165.
-
McColl, K. E. (2010). Clinical practice. Helicobacter pylori infection. New England Journal of Medicine, 362(17), 1597-1604.
-
Wang, F., Meng, W., Wang, B., Qiao, L. (2014). Helicobacter pylori-induced gastric inflammation and gastric cancer. Cancer Letters, 345(2), 196-202.
-
Fischbach, L. A., van Zanten, S. V., Dickason, J. (2004). Meta-analysis: The efficacy, adverse events, and adherence related to first-line anti-Helicobacter pylori quadruple therapies. Alimentary Pharmacology & Therapeutics, 20(10), 1071-1082.
-
O’Connor, A., Liou, J. M., Gisbert, J. P., O’Morain, C. (2019). Treatment of Helicobacter pylori infection 2019. Helicobacter, 24(Suppl 1), e12640.
Estas referencias incluyen artículos y estudios recientes de alto impacto en el manejo, tratamiento y riesgos asociados con H. pylori.
Se recomienda consultar estas fuentes para obtener información detallada y basada en la evidencia científica más actualizada.
(Artículo redactado, según mis indicaciones, por IA y posteriormente corregido y modificado por holasoyramon)
Muchos besos y muchas gracias.
¡Nos vemos en el cine!

Chistes y críticas en holasoyramon.com
Crítico de Cine de El Heraldo del Henares
Para poner un comentario:
Hay 3 casillas.
En la superior va tu nombre.
En la segunda, la del medio, pon una dirección de correo electrónico.
La tercera, la de abajo de las tres, puedes dejarla en blanco o poner tu web.